Sebelumnya telah dijelaskan
bahwa Ksp disertakan hanya untuk garam sukar larut (dalam pelarut air) yang memiliki kelarutan
kecil. Setiap garam tentu memiliki harga Ksp yang berbeda-beda, kemudian adakah
kelarutan mempengaruhi Ksp suatu garam? Bagaimana hubungan kelarutan dan Ksp?
Analisislah hubungan
kelarutan dengan Ksp melalui 2 gambar dibawah ini…
AgCl AgI
Ksp
= 1,8. 10-10 Ksp = 1,5. 10-16
walaupun
terisi oleh ion Ag+ yang berikatan dengan ion dalam satu golongan
(VII A) tetapi menghasilkan data Ksp yang perbedaannya cukup besar. Dengan Ksp
AgCl yang lebih besar dari Ksp AgI, menurut kalian apakah kelarutan AgCl juga
akan lebih besar dari kelarutan AgI? Bukalah penentuan kelarutan berdasarkan Ksp ini…
Hubungan antara Ksp dengan Kelarutan suatu garam
Dengan
demikian, pada AgCl Ksp = 1,8. 10-10dan
AgI Ksp = 1,5. 10-16 bagaimana perbandingan kelarutan kedua senywa
tersebut? Dari gambar diatas kalian dapat mengetahui bahwa kelarutan akan
sebanding dengan Ksp suatu senyawa. Jadi kelarutan AgCl akan lebih besar dari
AgI, hal ini juga dapat kalian lihat dari gambar kedua larutan itu. Akan
terlihat AgI memiliki endapan yg lebih banyak, ini menandakan bahwa kelarutan
AgI kecil sehingga mudah terbentuk endapan. Semua itu dilihat secara
kualitatif, kemudian bagaimana kelarutan suatu senyawa secara kuantitatif???
 Film fotografi didasarkan pada kepekaan AgBr terhadap
cahaya. Ketika cahaya
mengenai AgBr, sebagian kecil
dari ion Ag+ direduksi menjadi logam perak. Sisa dari
ion Ag+ akan direduksi menjadi logam perak ketika film
dicuci dalam larutan pengembang (developer). AgBr yang tidak menyerap cahaya (sisa) kemudian
dikeluarkan dari film melalui pencucian untuk menyempurnakan gambar.
Film fotografi didasarkan pada kepekaan AgBr terhadap
cahaya. Ketika cahaya
mengenai AgBr, sebagian kecil
dari ion Ag+ direduksi menjadi logam perak. Sisa dari
ion Ag+ akan direduksi menjadi logam perak ketika film
dicuci dalam larutan pengembang (developer). AgBr yang tidak menyerap cahaya (sisa) kemudian
dikeluarkan dari film melalui pencucian untuk menyempurnakan gambar.
Contoh: Mari kita menghitung
kelarutan AgBr dalam
air (gram per liter), untuk menganalisis apakah air dapat digunakan untuk
mencuci AgBr yang tidak
menyerap cahaya?
Kita mulai dengan persamaan kesetimbangan
berikut:
konsentrasi ion-ion ini pada kesetimbangan adalah sama (satu ion Ag + dilepaskan untuk satu ion Br-).
[Ag+]
= [Br-]
Substitusikan persamaan ini ke dalam Ksp sehingga memberikan hasil:
[Ag+]2
= 5.0 x 10-13
[Ag+] = [Br-] = 7.1 x 10-7M
Setelah kita tahu berapa banyak mol AgBr larut dalam
satu liter air, kita
dapat menghitung kelarutan dalam gram per liter.
Kelarutan AgBr dalam air hanya
0,00013 gram per
liter. Oleh karena itu kurang
tepat untuk mencoba mencuci AgBr
yang dikeluarkan dari film fotografi dengan air.
Perhitungan kelarutan produk dengan garam
yang memiliki
perbandingan 1:1 seperti AgBr relatif mudah dilakukan. Lalu bagaimana kelarutan garam yang
memiliki perbangdingan 1:2 atau 2:1? Untuk menjawabnya, kalian dapat analisis hubungan
antara kelarutan garam dan konsentrasi ion nya pada kesetimbangan. Dengan membuka perbandingan kelarutanproduk dengan garam
Sebelumnya
kalian sudah mengetahui bahwa koefisien reaksi akan menentukan Ksp yang
dihasilkan. Pada garam CaF2: ( Ksp = 4,0 x 10-11)
kelarutan dalam
gram per liter (CaF2).
Dengan begitu, terlihat bahwa Ksp akan berbanding lurus dengan
kelarutan.





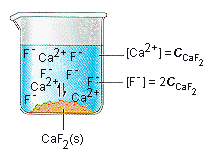
Tidak ada komentar:
Posting Komentar